草乌化学成分、药理作用、毒性及蒙医学毒性控制方法概述
发布时间:2024-12-09点击量:327
引用:乌尼日,包勒朝鲁.草乌化学成分、药理作用、毒性及蒙医学毒性控制方法概述[J].中医药导报,2024,30(1):93-99.
草乌为毛茛科植物北乌头(Aconitum kusnezoffii Reichb.)的干燥块根,是蒙医药中常见药材。草乌蒙药名为“泵阿”,用药频率高。据统计,在《中华人民共和国卫生部药品标准》这一蒙成药规范中,共收录145首方剂,使用草乌的方剂达28首,占19.3%;在《蒙古医学经典丛书·方剂学》所列224首蒙药复方中使用草乌的方剂达38首,占17.0%,其中单用制草乌、生草乌的方剂分别达24、3首[1]。蒙医认为草乌味辛,性温,效轻,有大毒。草乌具有杀“粘”、燥“协日乌素”、止痛等功效,主要用于流感、急慢性肠刺痛、粘刺痛、痈疖、丹毒、白喉、炭疽、脖颈僵直、“陶赖”、“赫如虎”、关节疼痛、偏头痛、心“赫依”等疾病[2]。近年来,研究者在其化学成分、药理作用、毒副作用、炮制减毒机理等方面进行了大量研究。笔者从化学成分、药理毒副作用、炮制减毒等方面进行综述,旨在为草乌深入的分子机制研究、质量控制、临床应用、新药开发提供参考。
1 草乌化学成分
在古代,草乌最早用于制造箭毒猎杀动物。《神农本草经》记载:“除寒湿痹,咳逆上气,破积聚寒热,其汁煎之名射罔,杀禽兽。”由此可见,草乌具有良好疗效的同时也具有很强的毒性。现代临床上,草乌常应用于治疗风寒湿痹、关节疼痛、麻醉、抗炎等方面。其临床疗效和毒性主要取决于化学成分。草乌主要含生物碱类及少量挥发性成分和多糖类。
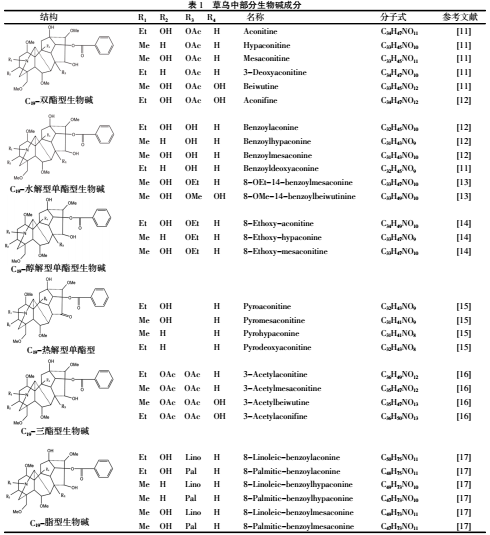
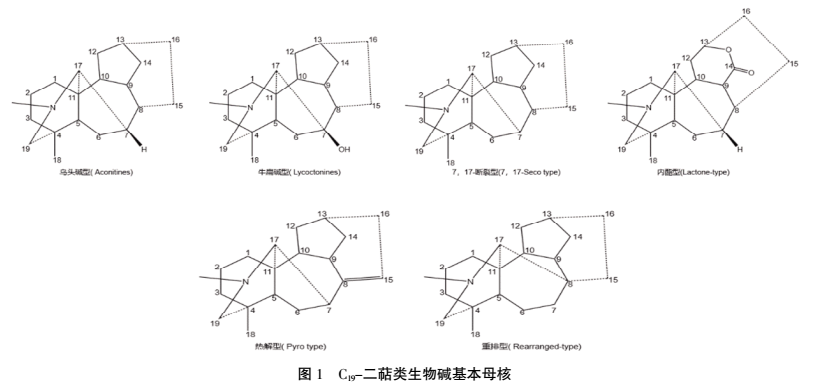
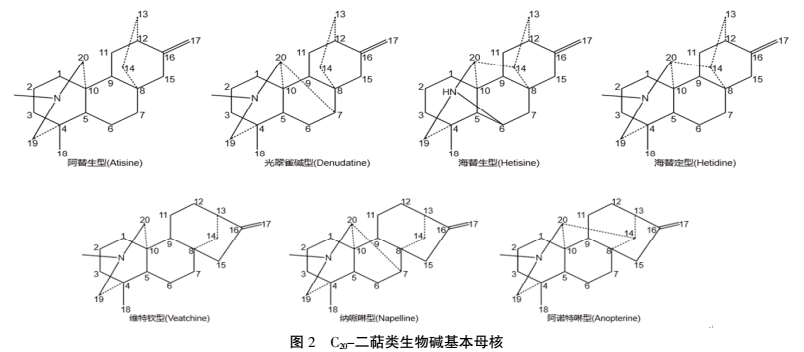
1.1 生物碱类 草乌主要含二萜类生物碱,基本母核为四环二萜或五环二萜,结构类型多而复杂。目前草乌中鉴定出了一百多种生物碱类成分[3],部分生物碱类成分见表1。其生物碱的结构类型,根据骨架碳数分为C18、C19、C20和双二萜生物碱,其酯化类型又可分为单酯型、双酯型和多酯型。至今为止,草乌中尚未发现C18-二萜类生物碱成分。C18-二萜类生物碱主要分布于牛扁亚属中,如高乌甲素、冉乌碱、高乌宁甲等,具有镇痛、抗炎、麻醉、解热、抗肿瘤、抗心律失常等药理活性。其中高乌甲素已开发为药物应用于临床上[4]。C19-二萜类生物碱为乌头生物碱的主要类型,具有抗炎、镇痛、麻醉、强心、抗肿瘤、抑菌、抗病毒等药理活性,同时也是主要毒性成分。根据C-7位是否有含氧基团及骨架的差异,C19-萜类生物碱可分为乌头碱型(Aconitines)、牛扁碱型(Lycoctonines)、7,17-断裂型(7,17-Seco type)、内酯型(Lactone-type)、热解型(Pyro type)及重排型(Rearranged-type)6种[5]。(见图1)草乌主要含乌头碱型生物碱,在较重要的乌头碱型生物碱中C8和C14的羟基常和乙酸、苯甲酸结合成酯,故其称为二萜双酯型生物碱。乌头碱、次乌头碱、新乌头碱等为双酯型生物碱,毒性极强,是草乌质量标准中需要限定的因素。将双酯型生物碱在碱水中加热,或将草乌直接浸泡于水中加热,或不加热在水中长时间浸泡,都可使酯基水解,生成无毒性的单酯型生物碱或无酯键的醇胺型生物碱。双酯型生物碱的水解受温度、pH、溶剂等多因素影响。乌头碱在低温加热时,C-8位的乙酰基水解,同时与C15的羟基缩合形成环氧烷,生成焦乌头碱,同时随着加热温度的升高,环氧烷开裂,生成单酯型生物碱苯甲酰次乌头原碱和无酯键的醇胺型生物碱乌头原碱。乌头碱还可以醇解成8-甲酰基乌头碱、3-脱水苯甲酰乌头碱、3-去氧焦乌头碱、3-脱水苯甲酰乌头原碱、焦印乌头原碱、印乌头碱、3-去氧-8-甲酰基乌碱等。温度和pH值的增加均可以加快双酯型生物碱的水解[6]。单酯型生物碱的毒性小于双酯型生物碱,醇胺型生物碱几乎无毒性,但它们均不降低原双酯型生物碱的疗效。草乌还含少量的C20-二萜类生物碱,其结构类型复杂多样,大多数具有环外双键,可分为阿替生型(Atisine)、光翠雀碱型(Denudatine)、海替生型(Hetisine)、海替定型(Hetidine)、维特钦型(Veatchine)、纳哌啉型(Napelline)、阿诺特啉型(Anopterine)等。(见图2)C20型二萜生物碱除具有抗炎、抗心律失常、麻醉、抗肿瘤等作用外,还具有抗血小板聚集作用[7-8]。
1.2 挥发油类 草乌含少量挥发油类成分,主要为脂肪酸及其酯类、胺类化合物。其挥发油类主要为有棕榈酸(C16H32O2)、O-邻(丁氧羰基)苯甲酰羟基乙酸乙酯(C18H24O6)、7-乙烯基十六内酯(C16H28O2)、邻苯二甲酸二丁酯(C16H22O4)、亚油酸甲酯(C19H34O2)、4-氨基联苯(C12H11N)、棕榈酸甲酯(C17H34O2)、十一烯酸(C11H20O2)、(顺,顺,顺)-9,12,15-十八烷三烯-l-醇(C18H32O)、十三烷酸乙酯(C15H30O2)、1,5-二甲基己胺(C8H19N)、N-甲基高藜芦胺(C11H17NO2)、N,N-二甲基苄胺(C9H13N)等,其中棕榈酸含量最高[9]。
1.3 糖类 草乌含鼠李糖(Rha)、木糖(Xyl)、甘露糖(Man)、阿拉伯糖(Ara)、葡萄糖(Glc)和半乳糖(Gal),其中甘露糖的含量最高,占总糖的78.27%[10]。
2 化学成分构效关系
二萜类生物碱是草乌特征性有效成分,也是致毒成分。二萜类生物碱在整体、离体、细胞水平均能发挥其药理活性和毒性作用。草乌药理活性和毒性作用与化学结构之间有着密切联系,C-8位的乙酰氧基(-OCOCH3)及C-14位的芳香酯基(-OCOC6H5)是草乌药理活性和毒性作用的重要基团,如乌头碱水解后先去除C-8位的乙酰氧基生成毒性较小的单酯型生物碱苯甲酰次乌头原碱后,再去除C-14位的芳香酯基则生成几乎无毒性的醇胺型生物碱乌头原碱。(见图3)乌头碱、次乌头碱、新乌头碱、3-乙酰基乌头碱的镇痛活性明显高于其水解产物。C-3位羟基的毒性和镇痛活性高于C-3位乙酰基,说明C-3位羟基的乙酰化可提高镇痛活性。C-14位芳香酯基或芳香酰基的镇痛活性和毒性强于C-4位芳香酯基。有研究还指出,C18和C19二萜类生物碱的镇痛活性与A环的三价N离子、C-8位的乙酰氧基或羟乙基取代、C-14位的芳香酯基取代和D环的饱和度有着密切关系。但是其抗炎活性恰恰相反,有研究报道虽然乌头碱、次乌头碱、新乌头碱、3-乙酰基乌头碱具有较强的抗炎活性,但是其水解产物的抗炎活性明显强于原型生物碱,有效成分的抗炎活性可能与C-8位的乙酰氧基有关。近年来,尚无直接比较草乌原双酯型生物碱和其水解产物抗炎活性的相关文献报道,因此抗炎和镇痛作用的有效成分需要用实验去验证。局部麻醉作用与C-14位和C-4位上的芳香酯基取代有关,且C-14位活性高于C-4位。局部麻醉作用还与分子量、核-核之间的排斥能量、空间的能量等有明显联系,其中分子量是最重要的结构参数,与其成正相关。其次是芳香环上C-5位及C-2位的反应活性指数,与其成负相关[18-19]。草乌的毒性靶器官主要是心血管系统和神经系统。草乌中致毒双酯型二萜生物碱的半数致死量与分子近似表面积、分子网络表面积、分子体积、水合能和分子键合能成呈相关,与分子疏水系数、摩尔折射率、极化能、分子量、形成热呈负相关[20]。

3 药理作用
草乌治疗窗较窄,临床上屡见因使用不当导致的不良反应和中毒现象,但在安全治疗范围内草乌具有抗炎、镇痛、抑菌、抗病毒、强心、抗肿瘤、局部麻醉等药理活性,特别是对炎性疼痛有较强的抑制作用。
3.1 抗炎镇痛作用 乌头碱和3-乙酰基乌头碱对热板刺激小鼠均有镇痛作用,并且两者无明显差异。研究发现,3-乙酰基乌头碱有较强的积蓄毒性,并出现耐受现象,因此口服给药时应注意其心脏毒性[21]。草乌水煮液可以减少醋酸所致小鼠扭体次数,并延长小鼠扭体潜伏期,延长热板刺激小鼠舔足潜伏期,提高热板小鼠痛阀值,抑制二甲苯所致小鼠耳廓肿胀、鸡蛋清所致大鼠足跖肿胀及巴豆油所致大鼠炎性肉芽肿的增生,减少炎性渗出液,具有明显的抗炎、镇痛作用[18]。乌头碱透皮给药后可明显延长醋酸所致小鼠扭体潜伏期,减少扭体次数,并且有明显的量-效关系,但到一定剂量后镇痛作用会达到平台期[22]。3-乙酰基乌头碱对醋酸致小鼠扭体反应有明显的抑制作用。研究发现,3-乙酰基乌头碱与盐酸吗啡或氯胺酮注射液合用的镇痛作用比单独使用作用强,且阈下剂量3-乙酰基乌头碱与阈下剂量盐酸吗啡或氯胺酮注射液有协同镇痛作用[23]。研究[24]发现,乌头酊直流电子导入可提高佐剂性关节炎大鼠中枢神经系统5-HT、NE及β-EP水平,从而达到抗炎、镇痛作用。生乌头和制乌头提取物及其制剂均对醋酸致小鼠扭体反应有明显的抑制作用,且生乌头提取物的镇痛效果优于制乌头[25]。
3.2 抗病毒和抑菌作用 次级代谢产物为乌头碱的白喉乌头根内生真菌对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和白色念球菌均有较强的抑菌活性[26]。乌头侧根中分离得到的内生真菌对金黄色葡萄球菌和四联球菌有明显的抑菌作用[27]。乌头碱对巨细胞病毒和烟草花叶病毒有抑制作用[28]。
3.3 抗肿瘤作用 近年来,研究发现草乌有效成分乌头碱有抑制癌细胞的作用[29],在临床上常被应用于缓解晚期癌症患者的疼痛,改善癌症患者的生活质量。乌头提取液对胃癌细胞(AGS)有抑制作用,在安全范围内生乌头提取液比制乌头效果更好[25]。草乌多糖铜配合物对肝癌细胞(HepG2)、乳腺癌细胞(MCF-7)和结肠癌细胞(HT-29)均表现出明显的抑制作用[30]。乌头碱能通过改变细胞因子水平,干预肺癌发生过程中上皮细胞-间充质转化(EMT)微环境,阻止肺癌发展[31]。乌头水煎液在维持Lewis肺癌细胞移植小鼠体温、血氧饱和度、红细胞ATP酶活性和血流的同时可改善瘤内缺氧状态和毛细血管通透性及细胞间连接通讯,阻止肿瘤生长和转移。乌头含药血清可以诱导肺癌细胞分化,抑制增殖和黏附,促进SDH活性及细胞间通讯,从而抑制肺癌细胞的生长[32]。乌头碱对前列腺癌细胞(DU145)有明显的抑制作用。其可能通过抑制JAK2/STAT3信号通路,抑制DU145增殖、侵袭,从而诱导细胞凋亡[33]。乌头碱对人肝癌细胞(MHCC97)增殖、侵袭和迁移具有明显的抑制作用,推测其作用机制可能与调控P38/MAPK信号通路激活有关[34]。3-乙酰基乌头碱和宋果灵可有效抑制人肝癌细胞(HepG2)活性,其中3-乙酰基乌头碱效果较强,并且两者均有明显的时间-效应和剂量-效应关系[35]。
3.4 对心血管系统的作用 低剂量生乌头提取物具有减慢心率的作用[25]。研究表明,低剂量乌头碱持续给药可诱导人多能干细胞分化心肌细胞(hiPSCs-CM)搏动周期缩短、兴奋传导延迟,但未见明显心率失常指征。代谢表型从氧化磷酸化向糖酵解方向偏移,为心肌细胞高频搏动快速提供能量,使脂肪酸代谢调控关键基因(FATP、ACC、CPT1)表达降低,葡萄糖转运蛋白1(Glut1)与转运蛋白4(Glut4)含量比值升高,导致hiPSCs-CM的心肌能量代谢模式重构,从而满足正性肌力所需能量。安全剂量下乌头碱给药初期有强心作用,且持续给药后虽未诱发心律失常,但会使心肌收缩率降低,存在慢性心脏毒性风险[36]。乌头碱可通过调节线粒体功能,改善能量代谢障碍,从而发挥对心肌组织的保护作用。Sirt3是乌头碱改善线粒体能量代谢的重要调控靶点[37]。乌头碱对心功能不全大鼠离体心脏具有强心作用,并且能激动心肌钾通道,增强乌头碱的强心作用和有效浓度范围[38]。
3.5 局部麻醉作用 临床中草乌通常与一些药物搭配使用作为局部麻醉药[39]。危亦林所创的“草乌散”(由猪牙皂角、木鳖子、紫金皮、白芷、半夏、乌药、川芎、杜当归、川乌、舶上茴香、坐拿草、草乌、木香13味药组成)是现存有记载的、最早的麻醉处方,主治损伤骨节不归窠者。现代研究也证实,草乌具有局部麻醉作用,其主要活性成分是乌头碱。
3.6 其他作用 草乌的水溶性多糖成分具有抗氧化和免疫调节活性,能提高巨噬细胞的吞噬能力,促进脾淋巴细胞的生长[40]。新乌头碱、乌头碱、次乌头碱、宋果灵和附子灵等具有一定的杀虫活性[41]。新乌头碱对稻褐飞虱和苜蓿蚜有一定的杀虫活性,其活性与C-3位羟基有密切关系[42]。
4 草乌毒性
草乌作为药毒兼备的药材,必须进行炮制并严格按照医嘱使用,如果用之不当极易引起各种中毒表现[43]。中毒表现以心血管系统和神经系统毒性为主,其次是消化系统毒性,少数患者也会出现肾毒性。草乌中毒剂量因人而异,正常成年人口服纯乌头碱0.2 mg即可中毒,3~5 mg可致死。中毒临床症状有四肢、口舌及全身麻木,流涎,恶心,呕吐,腹痛,手足抽搐,头晕眼花,神志模糊,呼吸急促,烦躁,心慌,血压及体温下降,恶性心律失常,甚至休克。中毒严重患者可因循环衰竭、呼吸衰竭及严重的心律失常而死亡。目前草乌中毒后尚无特效解毒药,所以第一时间应进行催吐、洗胃、导泻,以防止毒素吸收,同时要纠正心律失常和让患者保持呼吸通畅,重度患者可采取血液净化等治疗[44-49]。
4.1 心血管系统毒性 心慌、血压下降、恶性心律失常均为乌头属植物引起的典型心血管系统毒性症状。乌头碱、次乌头碱、新乌头碱在整体、离体、细胞水平均能引起心律失常。研究发现,次乌头碱会使心肌细胞波动频率加快,改变心肌细胞膜通透性,使乳酸脱氢酶升高,细胞受损。随着浓度的增加和作用时间的延长,次乌头碱会引起少量心肌细胞死亡。次乌头碱致心律失常与Ca2+/CaM信号传导通路有关。次乌头碱可通过促进心肌细胞内Ca2+释放,降低体外原代培养心肌细胞的Cx43表达水平,并有一定的剂量依赖性,说明Cx43参与了次乌头碱作用下的心律失常的发生和心肌的自我保护过程[50]。乌头碱、次乌头碱、新乌头碱均能增加心肌细胞舒张期钙浓度、钙瞬变的幅度和收缩功能,并有浓度依赖性,同时也可使自发性钙释放增加。作用强度:新乌头碱>乌头碱>次乌头碱,表明这3种乌头碱的正性肌力作用与毒性效应同时存在[51]。
4.2 神经毒性 口唇及四肢麻木、颤抖、运动障碍均为乌头属植物引起神经毒性的典型症状。严妍等[52]对体外培养的胎鼠中脑多巴胺能神经元用乌头碱染毒48 h后观察发现,其细胞体出现皱缩,突触断裂,神经纤维萎缩变短或缺失,细胞数减少,树突不同程度的缩短,数量降低,说明其对神经细胞生长有明显的抑制作用,且这种神经毒性具有浓度依赖性[52]。研究[53]发现,大鼠尾静脉快速注射乌头碱(20μg/kg)后,其脑额叶皮质谷氨酸(Glu)含量升高;脑额叶皮质抑制性氨基酸(GABA)早期含量降低,后期升高;神经元肿胀、凋亡,神经元核膜模糊不清,核仁消失,线粒体减少或损伤。王翀昊等[54]采用乌头碱作用于斑马鱼胚胎和幼鱼发育过程,发现乌头碱可抑制乙酰胆碱酯酶活性,降低初级感觉神经元凋亡,从而产生神经毒性。
4.3 生殖毒性 谢辉辉等[55]以人绒毛膜肿瘤细胞(BeWo)建立体外胎盘模型,用乌头碱及其水解产物苯甲酰乌头原碱干预,并分析BeWo细胞代谢物。结果表明,其主要通过氨基酸代谢产生毒性作用,而且乌头碱产生毒性比苯甲酰乌头原碱强。其主要涉及的代谢通路有谷氨酰胺和谷氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,赖氨酸降解,精氨酸和脯氨酸代谢,以及组氨酸代谢等6条代谢通路。
4.4 胚胎毒性 乌头碱对大鼠卵巢颗粒细胞的增殖有抑制作用。雌二醇和孕酮的含量随乌头碱剂量增加而有下降趋势,但不明显。作用机制可能为使细胞内的酶系统与非酶系统产生自由基,而非酶系统产生的自由基攻击生物膜中的不饱和脂肪酸引发脂质过氧化,形成新的氧自由基或脂质过氧化物,从而引起卵巢颗粒细胞的损伤[56]。雌性妊娠大鼠灌胃生草乌(8.3 g/kg)后出现胎鼠胸骨固化数减少,胚胎发育迟缓但不属于畸形[57]。
4.5 遗传毒性 生草乌对小鼠伤寒沙门菌体外回复突变实验(Ames)和彗星实验(Comet
assay)结果均呈阳性,说明生草乌会诱导微生物突变,损伤小鼠骨髓细胞的DNA,毒性跟浓度呈线性关系,具有一定的遗传毒性[58]。韦寿莲等[59]予家兔灌胃草乌乙醇提取液5周后,采用高效液相色谱-紫外检测法(HPLC-UV)检测血清和尿液中的8-羟基脱氧尿苷(8-OHdG)含量,结果也证明草乌具有明显的遗传毒性[59]。
5 蒙医学草乌毒性控制方法
对于有毒药材,复杂的加工程序可达到减毒存效的目的。加工过程主要是药材中化学成分发生复杂的量变和质变的过程。传统炮制和配伍应用基于临床经验、相关的医药学理论对药材进行加工处理,并根据药性特点组方控制达到减毒目的。这是人们在长期的实践中不断地摸索和改进的有效减毒方法。草乌所含的双酯型生物碱有剧毒,因此通常炮制或配伍使用。草乌双酯型生物碱不稳定,水中长时间浸泡或者加热都可使酯基水解,减弱其毒性。蒙医传统炮制方法有诃子制、童尿制、酒泡、酸奶制、去皮去尖、搅拌发锈制、烘制(烟熏制)等。其中,烘制法是蒙药传统烟熏法的改进法,可避免接触大量水,在降低毒性的同时最大程度保留了总生物碱成分[60]。此方法已被收录于2020年版《内蒙古蒙药饮片炮制规范》中。草乌不同的炮制方法各有特点,原理不尽相同。不同炮制减毒原理见表2。

6 总结与展望
草乌是毒性与药效共存的天然药物,因其资源分布广泛且有较强的抗炎、镇痛等药理活性,数千年来广受中医、蒙医、藏医等不同医学理论体系的青睐。在安全剂量范围内草乌可发挥显著的抗炎、镇痛、抑菌、抗病毒等药理活性,超出剂量范围则会导致不同程度中毒,以心血管系统和神经系统毒性为主,其次是消化系统毒性,严重者可危及生命。因此草乌通常炮制使用。草乌所含的二萜类生物碱既是致毒成分也是主要活性成分,其成分结构与药理活性和毒性有着密切联系。草乌炮制减毒是将其有毒化学成分进行量变和质变的过程。民族医药历来强调整体效用,药理活性广泛,多成分、多靶点共同发挥协同作用。因此基于化学成分结构与药理活性和毒性之间的相关性,从分子、细胞、组织、器官、生物体等各个方面研究草乌对机体的药理作用,将药物活性发挥至极致,具有重要意义。后续研究可在此基础上筛选出单一活性成分,定向进行化学结构改造、寻找低毒性、高药理活性的单体化合物。
参考文献
[1]乌日汉,孟香花,宝乐尔,等.蒙药草乌毒性研究概况[J].中华中医药杂志,2021,36(7):4159-4162.
[2]国家中医药管理局《中华本草》编委会.中华本草·蒙药卷[M].上海:上海科学技术出版社,2004.
[3]戴胜云,崔议方,徐静,等.草乌、川乌及附子中生物碱类成分的UHPLC-Q-Exactive Orbitrap MS/MS对比分析[J].中国中药杂志,2023,48(1):126-139.
[4]徐斌,张琴,郭夫江,等.高乌头的研究进展[J].中成药,2016,38(4):882-890.
[5]尹田鹏,罗智慧,蔡乐,等.天然C19-二萜生物碱的研究进展及其核磁共振波谱特征[J].波谱学杂志,2019,36(1):113-126.
[6]周远鹏.从双酯型生物碱的水解来看附子的解毒(二)[J].中药药理与临床,2014,30(3):154-157.
[7]李瑞阳,冯锋,刘静涵.C20型二萜生物碱的构效关系研究进展[J].海峡药学,2013,25(12):1-4.
[8]伍振金,杨春华,叶文才,等.C20型二萜生物碱的药理活性研究进展[J].药学进展,2011,35(6):241-249.
[9]赵英永,戴云,崔秀明,等.草乌中挥发油化学成分的研究[J].中成药,2007,29(4):588-590.
[10]孙玉军,陈彦,吴佳静.草乌多糖的分离纯化和组成性质研究[J].中国药学杂志,2000,35(11):11-13.
[11]王永高,朱元龙,朱任宏.中国乌头的研究ⅩⅢ.北草乌中的生物碱[J].药学学报,1980,15(9):526-531.
[12]李正邦,吕光华,陈东林,等.草乌中生物碱的化学研究[J].天然产物研究与开发,1997,9(1):9-14.
[13] LI Q,SUN S D,WANG M Y,et al.
Chemical constituents and analgesic activity of Aconitum Rusnezoffii Reichb[J].
Journal of Chinese Pharmaceutical Sciences,2018,27(12):855-863.
[14]张翅,潘德林,朱雅宁,等.附子中6种生物碱质谱裂解机制及醇解产物研究[J].中国中医急症,2016,25(12):2278-2282.
[15]王峰峰,宋兆辉,张兰兰,等.乌头碱、新乌头碱、次乌头碱水解和醇解产物的研究[J].中国中药杂志,2012,37(11):1564-1569.
[16]许庆轩,王勇,刘志强,等.草乌中二萜类生物碱的电喷雾串联质谱研究[J].高等学校化学学报,2005,26(4):638-641.
[17]辛杨,刘志强,盛伟,等.草乌中脂类生物碱在高温高压条件下的分解反应[J].中国中药杂志,2009,34(17):2212-2216.
[18]张宏,余成浩,彭成.草乌煎煮时间、给药剂量与抗炎镇痛功效的相关性研究[J].中药材,2006,29(12):1318-1322.
[19]王慧玉,孙晖,陆欣,等.乌头属中药成分的构效关系研究进展[J].世界科学技术-中医药现代化,2011,13(6):1022-1026.
[20]李晓,毕开顺,李清,等.基于偏最小二乘法的二萜类生物碱化合物毒性定量构效关系研究[J].计算机与应用化学,2016,33(2):228-230.
[21]梁颖彬,王莉芳,马小亚,等.3—乙酰乌头碱与乌头碱毒性及镇痛作用的比较研究[J].西北药学杂志,1991,6(3):1-3.
[22]孙虎,王平.乌头碱经皮给药的急性毒性及相关的镇痛作用研究[J].中成药,2012,34(11):2064-2067.
[23]姚婉霞,陈夏平,张艳丽.三乙酰乌头碱镇痛作用及机制的初步研究[J].宁夏医学杂志,2014,36(5):388-390.
[24]康乐,岳寿伟,王晓聆,等.乌头碱直流电离子导入对大鼠关节炎的镇痛作用及其机制探讨[J].中华物理医学与康复杂志,2005,27(12):733-736.
[25]杨苗苗,陈燕,杨霖,等.生乌头与制乌头提取物的药理评价[J].中国实验方剂学杂志,2019,25(16):44-49.
[26]玛依拉·吐尔德别克,吾鲁木汗·那孜尔别克,张娜,等.乌头内生真菌YLAC-3抗菌活性及其鉴定[J].吉首大学学报(自然科学版),2017,38(6):52-57.
[27]夏飞,上官晓雨,冯思亮,等.乌头中内生真菌的分离鉴定及其抑菌活性和机制研究[J].陕西科技大学学报,2019,37(6):66-72.
[28] XU W M,ZHANG M,LIU H W,et al.
Antiviral activity of aconite alkaloids from Aconitum carmichaelii debx[J]. Nat
Prod Res,2019,33(10):1486-1490.
[29]张佳艺,闫梓乔,杜璐瑶,等.乌头抗肿瘤的应用及研究[J].中医药导报,2019,25(10):45-49.
[30]张茜.草乌多糖金属配合物的制备和抗癌活性研究及1,2,4-三氮唑三氮烯类化合物的合成和生物活性研究[D].郑州:郑州大学,2017.
[31]马小芳.乌头碱调控上皮间充质转化微环境降低肺癌恶性的研究[D].开封:河南大学,2017.
[32]赵贝,侯西栋,李红,等.黄连与乌头对lewis肺癌细胞分化的作用比较[J].中国中药杂志,2014,39(14):2732-2738.
[33]蔡国强.乌头碱对前列腺癌细胞增殖、侵袭与凋亡的影响及其机制[J].中国老年学杂志,2022,42(9):2263-2266.
[34]高运军,李丽,李文.癌痛宁巴布剂中乌头碱的体外透皮吸收研究[J].中成药,2008,30(11):1619-1620.
[35]孙建瑞,邱智军,王大红,等.铁棒锤中3-乙酰乌头碱和宋果灵抗肿瘤活性[J].精细化工,2018,35(7):1163-1169.
[36]刘泓,岳兰昕,邱丽珍,等.低剂量乌头碱持续给药重塑hiPSCs-CM线粒体能量代谢模式[J].中国药理学通报,2021,37(5):617-623.
[37]王宁宁.乌头碱激活Sirt3改善心肌细胞线粒体功能[D].广州:广东药科大学,2019.
[38]张世忠,吴博威.乌头碱与钾离子通道激动剂合用对离体大鼠心脏的正性肌力作用研究[J].中国药理学通报,2001,17(5):570-572.
[39]徐浩,申旭霁,栾晶,等.中药口腔黏膜表面麻醉及临床应用[J].实用口腔医学杂志,2020,36(2):385-388.
[40] GAO T T,MA S,SONG J Y.
Antioxidant and immunological activities of water-soluble polysaccharides from
Aconitum kusnezoffii Reichb[J]. Int J Biol Macromol,2011,49(4):580-586.
[41]陈亚玲.生附子中二萜生物碱的成分及其杀虫活性研究[D].绵阳:西南科技大学,2009.
[42]王晓东,袁小红,杨海君,等.3,13-酯基中乌头碱衍生物的合成及其杀虫活性的研究[J].安徽农业科学,2009,37(21):9830-9831,9848.
[43]袁芳.乌头类中药在临床中的不良反应影响因素分析[J].中医药导报,2014,14(11):100-101.
[44]石银涛,罗敬锋,李恒,等.高分辨液质联用仪检验中毒事件中的生物碱[J].中国法医学杂志,2020,35(2):230-231.
[45]王永忠,熊昌艳,孙瑞清,等.生川乌及生草乌急性中毒死亡1例[J].中国法医学杂志,2011,26(2):146-147.
[46]王燕,张冬.反复电除颤成功抢救乌头碱中毒1例报告[J].医学理论与实践,2021,34(18):3303-3304.
[47]李园,汪文娟,龙再云,等.乌头碱中毒致多种心律失常2例[J].实用心电学杂志,2020,29(6):448-451.
[48]徐红,林津,刘孟庄,等.重度乌头碱中毒致血红蛋白尿2例[J].内科急危重症杂志,2002,8(3):128.
[49]卓明峰,黄刚,施倩玲.乌头中毒致恶性心律失常6例救治体会[J].中国医药指南,2018,16(25):16-17.
[50]李志勇.附子成分次乌头碱心脏毒性及中毒机制研究[D].北京:北京中医药大学,2008.
[51]余丞浩,于友华,孙明杰,等.乌头碱、新乌头碱及次乌头碱对心肌细胞钙释放的影响[J].国际中医中药杂志,2015,37(6):517-523.
[52]严妍,杨茂,Wolf-dieter
Rausch,等.乌头碱对胎鼠中脑多巴胺能神经元细胞的神经毒性作用[J].江苏大学学报(医学版),2013,23(3):212-215.
[53]支绍册,王磊,赵光举,等.双黄连注射液对大鼠急性乌头碱中毒脑损伤的干预研究[J].中华危重症医学杂志(电子版),2014,7(5):323-328.
[54]王翀昊,王心童,朱娜.乌头碱在斑马鱼胚胎和幼鱼发育过程中的神经毒性作用[J].中国实验诊断学,2018,22(8):1432-1435.
[55]谢辉辉,谢彤,徐建亚,等.基于代谢组学方法研究乌头碱和苯甲酰乌头原碱对BeWo细胞的毒性机制[J].分析化学,2015,43(12):1808-1813.
[56]刘强强,何晓娟,严光焰,等.乌头碱对大鼠卵巢颗粒细胞毒性研究[J].现代预防医学,2010,37(2):299-301.
[57]肖凯,李宏霞,王亚其,等.乌头类中药的胚胎毒性及致畸性[J].中国药科大学学报,2005,36(6):567-571.
[58]曹向宇,杨雷,宋尧,等.生草乌及清蒸草乌遗传毒性检测分析[J].中国公共卫生,2009,25(7):831-832.
[59]韦寿莲,严子军,刘玲,等.草乌对DNA损伤水平的高效液相色谱测定研究[J].分析测试学报,2011,30(7):755-759.
[60]韩志强,那生桑.蒙药草乌炮制方法的研究[J].世界科学技术(中医药现代化),2008,10(1):150-154.
[61]包勒朝鲁,那生桑.诃子解草乌毒蒙医传统观念及现代研究概况[J].中药药理与临床,2020,36(5):223-227.
[62]策力木格,许良,松林,等.基于UPLC-Q-TOF/MS技术结合序贯代谢法研究诃子汤炮制草乌机理[J].世界科学技术-中医药现代化,2022,24(8):2995-3013.
[63]邹恩济,白音夫,简伯阳,等.蒙药草乌人工尿炮制的初步研究[J].中药材,1993,16(12):22-23.
(收稿日期:2022-12-28 编辑:刘颖)